采纳股份子公司被FDA进口警示 医疗器械企业出海迎新挑战
上证报中国证券网讯(记者 张雪)FDA高度重视海外检查,中国药械企业迎新挑战。
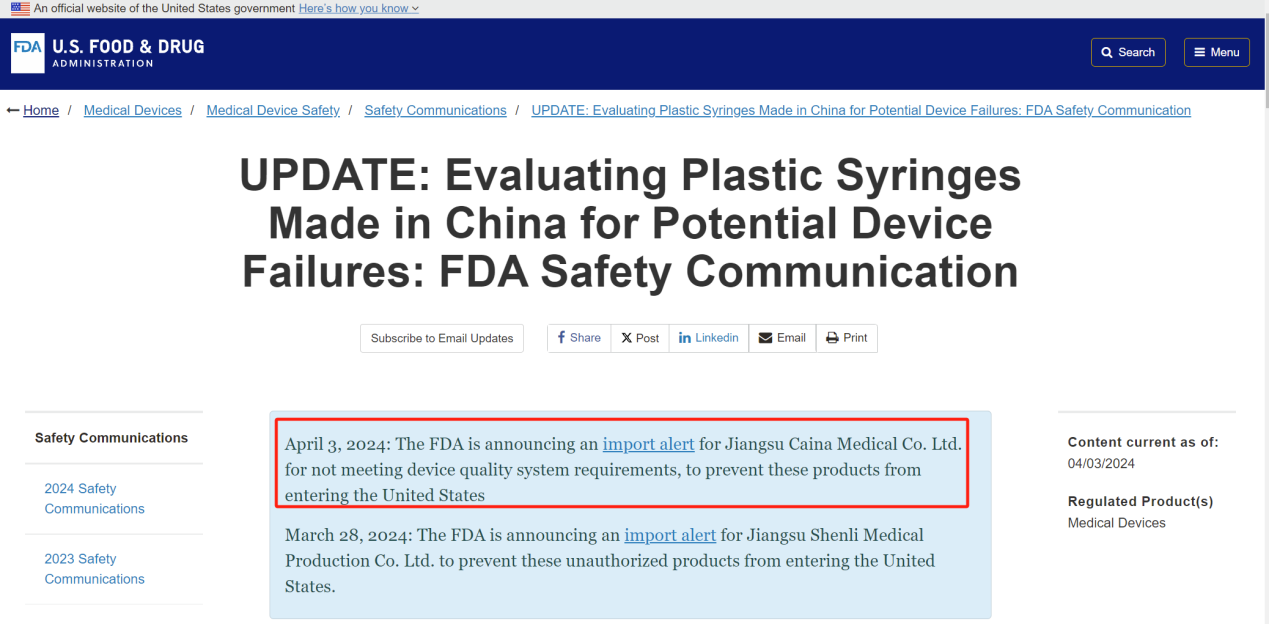
4月8日,采纳股份发布公告称,公司近日关注到FDA(美国食品药品监督管理局)官网发布的关于医疗器械的安全通讯,该通讯涉及对公司全资子公司江苏采纳医疗科技有限公司(下称“采纳医疗”)出具的进口警示。

公告显示,4月3日,FDA宣布对采纳医疗发出进口警示,称其不符合器械质量体系要求,以防止塑料注射器产品进入美国。该进口警示将导致采纳医疗部分的医疗器械产品可以被美国海关执行不经检查即扣留,致使部分医用注射器产品暂时无法进入美国市场。
兽用注射穿刺器械龙头被警示
公开资料显示,采纳股份是国内兽用注射穿刺器械龙头,公司目前包含了医疗器械、动物器械、实验室耗材等三大业务板块,主要产品包括穿刺针、注射器、实验室耗材等。采纳股份产品以出口为主,出口营收额占比超过90%,部分兽用器械直接销售至国内养殖企业。
采纳医疗是采纳股份的重要子公司,主要从事医用器械的研发、生产及销售。2022年,采纳医疗实现营业收入3.12亿元,实现净利润9689.44万元,分别占到上市公司相关财务指标的67%、60%。
截至2022年末,采纳股份及下属全资子公司已有26 项自有产品获得美国 FDA 510K注册,注册数量在同行业中处于领先地位。
采纳股份表示,公司目前正通过律师与FDA方面保持积极沟通解决上述问题,但目前尚无法精准预计能否移出警示名录以及移出的具体时间,在采纳医疗未被移出上述名录之前,采纳医疗部分医用注射器产品将暂时无法进入美国市场,预计对公司后续的主营业务收入和利润产生重大影响。
此外,3月28日,FDA还对江苏神力医疗制品有限公司发出过进口警告。
FDA被联名要求加强海外医械检查
记者注意到,2023年下半年开始,有多家医疗器械行业公司都接受了三年疫情之后新一轮FDA检查。
据沙格咨询信息显示,2023年底,美国8位参议员曾联名致信FDA局长,批评FDA的外国药品和医疗器械生产标准,并要求提供有关FDA打算如何增加国外(主要是中国和印度)检查频率的信息。
联名信明确提出,数据显示,FDA在2022年仅完成了对中国药品制造商的8次检查,对中国器械制造商的检查为零。同年,FDA完成了对美国药品生产企业的897次检查和对器械制造商的1706次检查。联名信强调,FDA对外国设施的检查不严和不频繁,威胁到患者,同时也威胁到要求更高标准的本国生产商。
客观来看,受疫情原因影响,FDA在2020至2022财年期间,对海外工厂的飞行检查行为频次锐减。据联名信,2020至2022财年期间,FDA仅在中国进行了40次检查,相比较2019年的131次明显减少。
去年11月底, FDA向消费者、医疗机构发出安全通知,称他们正在监测和评估几家中国注射器制造商所产的塑料注射器是否有可能出现安全问题。“FDA继续密切监控与这一新出现的安全问题相关的所有信息来源。”FDA设备和放射性健康中心的新闻官Kristina Wieghmink彼时称,“我们还与联邦合作伙伴合作,进一步测试中国制造的注射器,并计划与制造商合作,确保采取适当的纠正行动。”
FDA此前曾发表“退群”宣言
同样是去年11月底,一则重磅消息一度让全球医疗器械监管领域为之震动——FDA致信全球医疗器械法规协调组织(GHWP)主席,同时也是中国国家药品监督管理局副局长徐景和,宣布退出GHWP。

GHWP是全球医疗器械领域历史最悠久、成员最广泛的国际组织之一,是目前全球唯一的由监管机构代表和行业代表共同参与的国际医疗器械监管法规交流平台,其前身是亚洲医疗器械法规协调会(AHWP)。2021年12月份正式更名为GHWP。随着成员数量不断增多,其国际影响力持续提升,成员范围已从亚洲扩展到中东、南北美洲和非洲,覆盖33个国家和地区,其中近80%的国家和地区位于“一带一路”沿线。
行业人士彼时指出,FDA的退出,可能导致全球医疗器械法规出现分歧,企业可能需要面对更为复杂和多样化的法规环境,提高合规性的挑战。鉴于美国FDA退出GHWP可能导致法规环境的不确定性增加,企业应强化内部合规性团队,确保团队具备跨国法规了解和适应的能力,以降低合规性风险。
行业人士表示,2024年开始,中国医疗器械企业及产品的全球化发展,出海进程,将经历更为严格的监管态势,不断提升产品质量以及增强产品在当地市场的适应性与合规性将是关键。